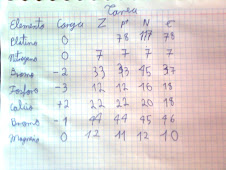
lunes, 4 de abril de 2011
lunes, 21 de marzo de 2011
Tarea , Subproceso 1
Subproceso 1:
Actividad 1:
Visita la página siguiente y obtén la configuración electrónica del carbono:
Respuesta:
La configuración electrónica del carbono es:
[C]=1s2 2s2 2px1 2py1 2pz0
Dada la poca diferencia de energía entre los orbitales 2s y los 2p es fácil promocionar un electrón 2s a un orbital 2p, obteniéndose la configuración:
[C]=1s2 2s1 2px1 2py1 2pz1
y esta conformada con : 2 niveles de energía. Total de electrones: 6 . Distribución de los electrones en niveles: primer nivel: 2 electrones , segundo nivel: 4 electrones, distribuidos en dos subniveles, 2 es en el s y 2 en el p . Electrones de valencia: 4
Actividad 2:
¿Cuántos enlaces puede formar el carbono? ¿De qué tipo?
tiene cuatro electrones de enlace en su envoltura de valencia. Al igual que otros no metales, el carbono necesita ocho electrones para completar su envoltura de valencia. Por consiguiente, el carbono forma cuatro enlaces con otros átomos (cada enlace representa a uno de los electrones de carbono y uno de los electrones del átomo que se enlazan). Cada valencia de electrón participa en el enlace, por consiguiente el enlace del átomo de carbono se distribuirá parejamente sobre la superficie del átomo. Estos enlaces forman un tetraedro (una pirámide con una punta en la parte superior).
Actividad 4: Una vez determinada cómo se enlaza el carbono para formar compuestos orgánicos nos preguntamos, ¿cuáles son las características o propiedades de los compuestos orgánicos?
Las características : son combustibles , poco densos , contienen electro conductores , poco hidrosolubles , pueden ser de origen natural u origen sintético , ¡tienen carbono! , casi siempre tienen hidrogeno , componen la materia vivía , su enlace mas fuerte es el covalente , presentan isomería , existen mas de 4 millones de compuestos orgánicos , presentan concatenación.
Y sus propiedades son :
los compuestos orgánicos covalentes se distinguen de los compuestos inorgánicos en que tienen puntos de fusión y ebullición más bajos.
Gran parte de los compuestos orgánicos tienen los puntos de fusión y ebullición por debajo de los 300 °C, aunque existen excepciones. Por lo general, los compuestos orgánicos se disuelven en disolventes no polares (líquidos sin carga eléctrica localizada) como el octano o el tetracloruro de carbono, o en disolventes de baja polaridad, como los alcoholes, el ácido etanoico (ácido acético) y la propanona (acetona). Los compuestos orgánicos suelen ser insolubles en agua, un disolvente fuertemente polar.
Los hidrocarburos tienen densidades relativas bajas, con frecuencia alrededor de 0,8, pero los grupos funcionales pueden aumentar la densidad de los compuestos orgánicos. Sólo unos pocos compuestos orgánicos tienen densidades mayores de 1,2, y son generalmente aquéllos que contienen varios átomos de halógenos.
Los grupos funcionales capaces de formar enlaces de hidrógeno aumentan generalmente la
viscosidad (resistencia a fluir). Por ejemplo, las viscosidades del etanol, 1,2-etanodiol (etilenglicol) y 1,2,3-propanotriol (glicerina) aumentan en ese orden. Estos compuestos contienen uno, dos y tres grupos OH respectivamente, que forman enlaces de hidrógeno fuertes.
Actividad 5: ¿Cómo se representan los compuestos orgánicos? ¿Qué tipo de fórmulas se utilizan?
Se representan a través de formulas químicas que se clasifican en empíricas, moleculares y geométricas.
Actividad 1:
Visita la página siguiente y obtén la configuración electrónica del carbono:
Respuesta:
La configuración electrónica del carbono es:
[C]=1s2 2s2 2px1 2py1 2pz0
Dada la poca diferencia de energía entre los orbitales 2s y los 2p es fácil promocionar un electrón 2s a un orbital 2p, obteniéndose la configuración:
[C]=1s2 2s1 2px1 2py1 2pz1
y esta conformada con : 2 niveles de energía. Total de electrones: 6 . Distribución de los electrones en niveles: primer nivel: 2 electrones , segundo nivel: 4 electrones, distribuidos en dos subniveles, 2 es en el s y 2 en el p . Electrones de valencia: 4
Actividad 2:
¿Cuántos enlaces puede formar el carbono? ¿De qué tipo?
tiene cuatro electrones de enlace en su envoltura de valencia. Al igual que otros no metales, el carbono necesita ocho electrones para completar su envoltura de valencia. Por consiguiente, el carbono forma cuatro enlaces con otros átomos (cada enlace representa a uno de los electrones de carbono y uno de los electrones del átomo que se enlazan). Cada valencia de electrón participa en el enlace, por consiguiente el enlace del átomo de carbono se distribuirá parejamente sobre la superficie del átomo. Estos enlaces forman un tetraedro (una pirámide con una punta en la parte superior).
Actividad 4: Una vez determinada cómo se enlaza el carbono para formar compuestos orgánicos nos preguntamos, ¿cuáles son las características o propiedades de los compuestos orgánicos?
Las características : son combustibles , poco densos , contienen electro conductores , poco hidrosolubles , pueden ser de origen natural u origen sintético , ¡tienen carbono! , casi siempre tienen hidrogeno , componen la materia vivía , su enlace mas fuerte es el covalente , presentan isomería , existen mas de 4 millones de compuestos orgánicos , presentan concatenación.
Y sus propiedades son :
los compuestos orgánicos covalentes se distinguen de los compuestos inorgánicos en que tienen puntos de fusión y ebullición más bajos.
Gran parte de los compuestos orgánicos tienen los puntos de fusión y ebullición por debajo de los 300 °C, aunque existen excepciones. Por lo general, los compuestos orgánicos se disuelven en disolventes no polares (líquidos sin carga eléctrica localizada) como el octano o el tetracloruro de carbono, o en disolventes de baja polaridad, como los alcoholes, el ácido etanoico (ácido acético) y la propanona (acetona). Los compuestos orgánicos suelen ser insolubles en agua, un disolvente fuertemente polar.
Los hidrocarburos tienen densidades relativas bajas, con frecuencia alrededor de 0,8, pero los grupos funcionales pueden aumentar la densidad de los compuestos orgánicos. Sólo unos pocos compuestos orgánicos tienen densidades mayores de 1,2, y son generalmente aquéllos que contienen varios átomos de halógenos.
Los grupos funcionales capaces de formar enlaces de hidrógeno aumentan generalmente la
viscosidad (resistencia a fluir). Por ejemplo, las viscosidades del etanol, 1,2-etanodiol (etilenglicol) y 1,2,3-propanotriol (glicerina) aumentan en ese orden. Estos compuestos contienen uno, dos y tres grupos OH respectivamente, que forman enlaces de hidrógeno fuertes.
Actividad 5: ¿Cómo se representan los compuestos orgánicos? ¿Qué tipo de fórmulas se utilizan?
Se representan a través de formulas químicas que se clasifican en empíricas, moleculares y geométricas.
Subproceso 2
Subproceso 2:
Actividad 1:
Visita la página siguiente y obtén la configuración electrónica del carbono:
Respuesta:
La configuración electrónica del carbono es:
[C]=1s2 2s2 2px1 2py1 2pz0
Dada la poca diferencia de energía entre los orbitales 2s y los 2p es fácil promocionar un electrón 2s a un orbital 2p, obteniéndose la configuración:
[C]=1s2 2s1 2px1 2py1 2pz1
y esta conformada con : 2 niveles de energía. Total de electrones: 6 . Distribución de los electrones en niveles: primer nivel: 2 electrones , segundo nivel: 4 electrones, distribuidos en dos subniveles, 2 es en el s y 2 en el p . Electrones de valencia: 4
Actividad 2:
¿Cuántos enlaces puede formar el carbono? ¿De qué tipo?
tiene cuatro electrones de enlace en su envoltura de valencia. Al igual que otros no metales, el carbono necesita ocho electrones para completar su envoltura de valencia. Por consiguiente, el carbono forma cuatro enlaces con otros átomos (cada enlace representa a uno de los electrones de carbono y uno de los electrones del átomo que se enlazan). Cada valencia de electrón participa en el enlace, por consiguiente el enlace del átomo de carbono se distribuirá parejamente sobre la superficie del átomo. Estos enlaces forman un tetraedro (una pirámide con una punta en la parte superior).
Actividad 4: Una vez determinada cómo se enlaza el carbono para formar compuestos orgánicos nos preguntamos, ¿cuáles son las características o propiedades de los compuestos orgánicos?
Las características : son combustibles , poco densos , contienen electro conductores , poco hidrosolubles , pueden ser de origen natural u origen sintético , ¡tienen carbono! , casi siempre tienen hidrogeno , componen la materia vivía , su enlace mas fuerte es el covalente , presentan isomería , existen mas de 4 millones de compuestos orgánicos , presentan concatenación.
Y sus propiedades son :
los compuestos orgánicos covalentes se distinguen de los compuestos inorgánicos en que tienen puntos de fusión y ebullición más bajos.
Gran parte de los compuestos orgánicos tienen los puntos de fusión y ebullición por debajo de los 300 °C, aunque existen excepciones. Por lo general, los compuestos orgánicos se disuelven en disolventes no polares (líquidos sin carga eléctrica localizada) como el octano o el tetracloruro de carbono, o en disolventes de baja polaridad, como los alcoholes, el ácido etanoico (ácido acético) y la propanona (acetona). Los compuestos orgánicos suelen ser insolubles en agua, un disolvente fuertemente polar.
Los hidrocarburos tienen densidades relativas bajas, con frecuencia alrededor de 0,8, pero los grupos funcionales pueden aumentar la densidad de los compuestos orgánicos. Sólo unos pocos compuestos orgánicos tienen densidades mayores de 1,2, y son generalmente aquéllos que contienen varios átomos de halógenos.
Los grupos funcionales capaces de formar enlaces de hidrógeno aumentan generalmente la
viscosidad (resistencia a fluir). Por ejemplo, las viscosidades del etanol, 1,2-etanodiol (etilenglicol) y 1,2,3-propanotriol (glicerina) aumentan en ese orden. Estos compuestos contienen uno, dos y tres grupos OH respectivamente, que forman enlaces de hidrógeno fuertes.
Actividad 5: ¿Cómo se representan los compuestos orgánicos? ¿Qué tipo de fórmulas se utilizan?
Se representan a través de formulas químicas que se clasifican en empíricas, moleculares y geométricas.
Actividad 1:
Visita la página siguiente y obtén la configuración electrónica del carbono:
Respuesta:
La configuración electrónica del carbono es:
[C]=1s2 2s2 2px1 2py1 2pz0
Dada la poca diferencia de energía entre los orbitales 2s y los 2p es fácil promocionar un electrón 2s a un orbital 2p, obteniéndose la configuración:
[C]=1s2 2s1 2px1 2py1 2pz1
y esta conformada con : 2 niveles de energía. Total de electrones: 6 . Distribución de los electrones en niveles: primer nivel: 2 electrones , segundo nivel: 4 electrones, distribuidos en dos subniveles, 2 es en el s y 2 en el p . Electrones de valencia: 4
Actividad 2:
¿Cuántos enlaces puede formar el carbono? ¿De qué tipo?
tiene cuatro electrones de enlace en su envoltura de valencia. Al igual que otros no metales, el carbono necesita ocho electrones para completar su envoltura de valencia. Por consiguiente, el carbono forma cuatro enlaces con otros átomos (cada enlace representa a uno de los electrones de carbono y uno de los electrones del átomo que se enlazan). Cada valencia de electrón participa en el enlace, por consiguiente el enlace del átomo de carbono se distribuirá parejamente sobre la superficie del átomo. Estos enlaces forman un tetraedro (una pirámide con una punta en la parte superior).
Actividad 4: Una vez determinada cómo se enlaza el carbono para formar compuestos orgánicos nos preguntamos, ¿cuáles son las características o propiedades de los compuestos orgánicos?
Las características : son combustibles , poco densos , contienen electro conductores , poco hidrosolubles , pueden ser de origen natural u origen sintético , ¡tienen carbono! , casi siempre tienen hidrogeno , componen la materia vivía , su enlace mas fuerte es el covalente , presentan isomería , existen mas de 4 millones de compuestos orgánicos , presentan concatenación.
Y sus propiedades son :
los compuestos orgánicos covalentes se distinguen de los compuestos inorgánicos en que tienen puntos de fusión y ebullición más bajos.
Gran parte de los compuestos orgánicos tienen los puntos de fusión y ebullición por debajo de los 300 °C, aunque existen excepciones. Por lo general, los compuestos orgánicos se disuelven en disolventes no polares (líquidos sin carga eléctrica localizada) como el octano o el tetracloruro de carbono, o en disolventes de baja polaridad, como los alcoholes, el ácido etanoico (ácido acético) y la propanona (acetona). Los compuestos orgánicos suelen ser insolubles en agua, un disolvente fuertemente polar.
Los hidrocarburos tienen densidades relativas bajas, con frecuencia alrededor de 0,8, pero los grupos funcionales pueden aumentar la densidad de los compuestos orgánicos. Sólo unos pocos compuestos orgánicos tienen densidades mayores de 1,2, y son generalmente aquéllos que contienen varios átomos de halógenos.
Los grupos funcionales capaces de formar enlaces de hidrógeno aumentan generalmente la
viscosidad (resistencia a fluir). Por ejemplo, las viscosidades del etanol, 1,2-etanodiol (etilenglicol) y 1,2,3-propanotriol (glicerina) aumentan en ese orden. Estos compuestos contienen uno, dos y tres grupos OH respectivamente, que forman enlaces de hidrógeno fuertes.
Actividad 5: ¿Cómo se representan los compuestos orgánicos? ¿Qué tipo de fórmulas se utilizan?
Se representan a través de formulas químicas que se clasifican en empíricas, moleculares y geométricas.
Subproceso 3:
Subproceso 3:
Actividad 1: ¿Qué son los hidrocarburos?
Los hidrocarburos son compuestos orgánicos formados únicamente por "átomos de carbono e hidrógeno". La estructura molecular consiste en un armazón de átomos de carbono a los que se unen los átomos de hidrógeno. Los hidrocarburos son los compuestos básicos de la Química Orgánica. Las cadenas de átomos de carbono pueden ser lineales o ramificadas y abiertas o cerradas.
Los hidrocarburos se pueden diferenciar en dos tipos que son alifáticos y aromáticos. Los alifáticos, a su vez se pueden clasificar en alcanos, alquenos y alquinos según los tipos de enlace que unen entre sí los átomos de carbono. Las fórmulas generales de los alcanos, alquenos y alquinos son CnH2n+2, CnH2n y CnH2n-2, respectivamente.
Actividad 2: Realiza una clasificación de los hidrocarburos en función del tipo de enlace que presentan. Describe las propiedades más importantes de cada uno y cómo se formulan.
Los alcanos son hidrocarburos, es decir que tienen sólo átomos de carbono e hidrógeno. La fórmula general para alcanos alifáticos (de cadena lineal) es CnH2n+2, y para cicloalcanos es CnH2n. También reciben el nombre de hidrocarburos saturados.
Los alcanos son compuestos formados solo por átomos de carbono e hidrógeno, no presentan funcionalización alguna, es decir, sin la presencia de grupos funcionales como el carbonilo (-CO), carboxilo (-COOH), amida (-CON=), etc. La relación C/H es de CnH2n+2 siendo n el número de átomos de carbono de la molécula, (como se verá después esto es válido para alcanos de cadena lineal y cadena ramificada pero no para alcanos cíclicos). Esto hace que su reactividad sea muy reducida en comparación con otros compuestos orgánicos, y es la causa de su nombre no sistemático: parafinas (del latín, poca afinidad). Todos los enlaces dentro de las moléculas de alcano son de tipo simple o sigma, es decir, covalentes por compartición de un par de electrones en un orbital s, por lo cual la estructura de un alcano sería de la forma:
Los alquenos u olefinas son hidrocarburos insaturados que tienen uno o varios dobles enlaces carbono-carbono en su molécula. Se puede decir que un alqueno no es más que un alcano que ha perdido dos átomos de hidrógeno produciendo como resultado un enlace doble entre dos carbonos. Los alquenos cíclicos reciben el nombre de cicloalquenos.
Los alquinos son hidrocarburos alifáticos con al menos un triple enlace entre dos átomos de carbono. Se trata de compuestos metaestables debido a la alta energía del triple enlace carbono-carbono. Su fórmula general es CnH2n-2.





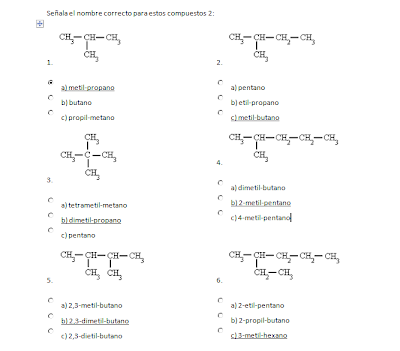


Actividad 4: ¿Dé que están formados el petróleo y el gas natural? Realiza un pequeño artículo donde se recojan las características de ambas sustancias, su uso, obtención y consecuencias para el medio ambiente.
El gas natural es una de las varias e importantes fuentes de energía no renovables formada por una mezcla de gases ligeros que se encuentra en yacimientos de petróleo, disuelto o asociado con el petróleo o en depósitos de carbón. Aunque su composición varía en función del yacimiento del que se saca, está compuesto principalmente por metano en cantidades que comúnmente pueden superar el 90 ó 95% (p. ej., el gas no-asociado del pozo West Sole en el Mar del Norte), y suele contener otros gases como nitrógeno, CO2, H2S, helio y mercaptanos. Como ejemplo de contaminantes cabe mencionar el gas no-asociado de Kapuni (NZ) que contiene hasta 49% de CO2. Como fuentes adicionales de este recurso natural, se están investigando los yacimientos de hidratos de metano que, según estimaciones, pueden suponer una reserva energética muy superiores a las actuales de gas natural.
Puede obtenerse también con procesos de descomposición de restos orgánicos (basuras, vegetales - gas de pantanos) en las plantas de tratamiento de estos restos (depuradoras de aguas residuales urbanas, plantas de procesado de basuras, de desechos orgánicos animales, etc.). El gas obtenido así se llama biogás.
Algunos de los gases que forman parte del gas natural cuando es extraído se separa de la mezcla porque no tienen capacidad energética (nitrógeno o CO2) o porque pueden depositarse en las tuberías usadas para su distribución debido a su alto punto de ebullición. Si el gas fuese criogénicamente licuado para su almacenamiento, el dióxido de carbono (CO2) solidificaría interfiriendo con el proceso criogénico. El CO2 puede ser determinado por los procedimientos ASTM D 1137 o ASTM D 1945.
El propano, butano e hidrocarburos más pesados en comparación con el gas natural son extraídos, puesto que su presencia puede causar accidentes durante la combustión del gas natural. El vapor de agua también se elimina por estos motivos y porque a temperaturas cercanas a la temperatura ambiente y presiones altas forma hidratos de metano que pueden obstruir los gasoductos. Los compuestos de azufre son eliminados hasta niveles muy bajos para evitar corrosión y olores perniciosos, así como para reducir las emisiones de compuestos causantes de lluvia ácida. La detección y la medición de H2S se puede realizar con los métodos ASTM D2385 o ASTM D 2725.
Para uso doméstico, al igual que al butano, se le añaden trazas de compuestos de la familia de los mercaptano entre ellos el metil-mercaptano, para que sea fácil detectar una fuga de gas y evitar su ignición espontánea.
El petróleo (del griego: πετρέλαιον, "aceite de roca")´ es una mezcla heterogénea de compuestos orgánicos, principalmente hidrocarburos insolubles en agua. También es conocido como petróleo crudo o simplemente crudo.
Es de origen fósil, fruto de la transformación de materia orgánica procedente de zooplancton y algas que, depositados en grandes cantidades en fondos anóxicos de mares o zonas lacustres del pasado geológico, fueron posteriormente enterrados bajo pesadas capas de sedimentos. La transformación química (craqueo natural) debida al calor y a la presión durante la diagénesis produce, en sucesivas etapas, desde betún a hidrocarburos cada vez más ligeros (líquidos y gaseosos). Estos productos ascienden hacia la superficie, por su menor densidad, gracias a la porosidad de las rocas sedimentarias. Cuando se dan las circunstancias geológicas que impiden dicho ascenso (trampas petrolíferas como rocas impermeables, estructuras anticlinales, márgenes de diapiros salinos, etc.) se forman entonces los yacimientos petrolíferos.
En condiciones normales es un líquido bituminoso que puede presentar gran variación en diversos parámetros como color y viscosidad (desde amarillentos y poco viscosos como la gasolina hasta líquidos negros tan viscosos que apenas fluyen), densidad (entre 0,75 g/ml y 0,95 g/ml), capacidad calorífica, etc. Estas variaciones se deben a la diversidad de concentraciones de los hidrocarburos que componen la mezcla.
Es un recurso natural no renovable y actualmente también es la principal fuente de energía en los países desarrollados. El petróleo líquido puede presentarse asociado a capas de gas natural, en yacimientos que han estado enterrados durante millones de años, cubiertos por los estratos superiores de la corteza terrestre.
En los Estados Unidos, es común medir los volúmenes de petróleo líquido en barriles (de 42 galones estadounidenses, equivalente a 158,987294928 litros), y los volúmenes de gas en pies cúbicos (equivalente a 28,316846592 litros); en otras regiones ambos volúmenes se miden en metros cúbicos.
Actividad 1: ¿Qué son los hidrocarburos?
Los hidrocarburos son compuestos orgánicos formados únicamente por "átomos de carbono e hidrógeno". La estructura molecular consiste en un armazón de átomos de carbono a los que se unen los átomos de hidrógeno. Los hidrocarburos son los compuestos básicos de la Química Orgánica. Las cadenas de átomos de carbono pueden ser lineales o ramificadas y abiertas o cerradas.
Los hidrocarburos se pueden diferenciar en dos tipos que son alifáticos y aromáticos. Los alifáticos, a su vez se pueden clasificar en alcanos, alquenos y alquinos según los tipos de enlace que unen entre sí los átomos de carbono. Las fórmulas generales de los alcanos, alquenos y alquinos son CnH2n+2, CnH2n y CnH2n-2, respectivamente.
Actividad 2: Realiza una clasificación de los hidrocarburos en función del tipo de enlace que presentan. Describe las propiedades más importantes de cada uno y cómo se formulan.
Los alcanos son hidrocarburos, es decir que tienen sólo átomos de carbono e hidrógeno. La fórmula general para alcanos alifáticos (de cadena lineal) es CnH2n+2, y para cicloalcanos es CnH2n. También reciben el nombre de hidrocarburos saturados.
Los alcanos son compuestos formados solo por átomos de carbono e hidrógeno, no presentan funcionalización alguna, es decir, sin la presencia de grupos funcionales como el carbonilo (-CO), carboxilo (-COOH), amida (-CON=), etc. La relación C/H es de CnH2n+2 siendo n el número de átomos de carbono de la molécula, (como se verá después esto es válido para alcanos de cadena lineal y cadena ramificada pero no para alcanos cíclicos). Esto hace que su reactividad sea muy reducida en comparación con otros compuestos orgánicos, y es la causa de su nombre no sistemático: parafinas (del latín, poca afinidad). Todos los enlaces dentro de las moléculas de alcano son de tipo simple o sigma, es decir, covalentes por compartición de un par de electrones en un orbital s, por lo cual la estructura de un alcano sería de la forma:
Los alquenos u olefinas son hidrocarburos insaturados que tienen uno o varios dobles enlaces carbono-carbono en su molécula. Se puede decir que un alqueno no es más que un alcano que ha perdido dos átomos de hidrógeno produciendo como resultado un enlace doble entre dos carbonos. Los alquenos cíclicos reciben el nombre de cicloalquenos.
Los alquinos son hidrocarburos alifáticos con al menos un triple enlace entre dos átomos de carbono. Se trata de compuestos metaestables debido a la alta energía del triple enlace carbono-carbono. Su fórmula general es CnH2n-2.
Actividad 4: ¿Dé que están formados el petróleo y el gas natural? Realiza un pequeño artículo donde se recojan las características de ambas sustancias, su uso, obtención y consecuencias para el medio ambiente.
El gas natural es una de las varias e importantes fuentes de energía no renovables formada por una mezcla de gases ligeros que se encuentra en yacimientos de petróleo, disuelto o asociado con el petróleo o en depósitos de carbón. Aunque su composición varía en función del yacimiento del que se saca, está compuesto principalmente por metano en cantidades que comúnmente pueden superar el 90 ó 95% (p. ej., el gas no-asociado del pozo West Sole en el Mar del Norte), y suele contener otros gases como nitrógeno, CO2, H2S, helio y mercaptanos. Como ejemplo de contaminantes cabe mencionar el gas no-asociado de Kapuni (NZ) que contiene hasta 49% de CO2. Como fuentes adicionales de este recurso natural, se están investigando los yacimientos de hidratos de metano que, según estimaciones, pueden suponer una reserva energética muy superiores a las actuales de gas natural.
Puede obtenerse también con procesos de descomposición de restos orgánicos (basuras, vegetales - gas de pantanos) en las plantas de tratamiento de estos restos (depuradoras de aguas residuales urbanas, plantas de procesado de basuras, de desechos orgánicos animales, etc.). El gas obtenido así se llama biogás.
Algunos de los gases que forman parte del gas natural cuando es extraído se separa de la mezcla porque no tienen capacidad energética (nitrógeno o CO2) o porque pueden depositarse en las tuberías usadas para su distribución debido a su alto punto de ebullición. Si el gas fuese criogénicamente licuado para su almacenamiento, el dióxido de carbono (CO2) solidificaría interfiriendo con el proceso criogénico. El CO2 puede ser determinado por los procedimientos ASTM D 1137 o ASTM D 1945.
El propano, butano e hidrocarburos más pesados en comparación con el gas natural son extraídos, puesto que su presencia puede causar accidentes durante la combustión del gas natural. El vapor de agua también se elimina por estos motivos y porque a temperaturas cercanas a la temperatura ambiente y presiones altas forma hidratos de metano que pueden obstruir los gasoductos. Los compuestos de azufre son eliminados hasta niveles muy bajos para evitar corrosión y olores perniciosos, así como para reducir las emisiones de compuestos causantes de lluvia ácida. La detección y la medición de H2S se puede realizar con los métodos ASTM D2385 o ASTM D 2725.
Para uso doméstico, al igual que al butano, se le añaden trazas de compuestos de la familia de los mercaptano entre ellos el metil-mercaptano, para que sea fácil detectar una fuga de gas y evitar su ignición espontánea.
El petróleo (del griego: πετρέλαιον, "aceite de roca")´ es una mezcla heterogénea de compuestos orgánicos, principalmente hidrocarburos insolubles en agua. También es conocido como petróleo crudo o simplemente crudo.
Es de origen fósil, fruto de la transformación de materia orgánica procedente de zooplancton y algas que, depositados en grandes cantidades en fondos anóxicos de mares o zonas lacustres del pasado geológico, fueron posteriormente enterrados bajo pesadas capas de sedimentos. La transformación química (craqueo natural) debida al calor y a la presión durante la diagénesis produce, en sucesivas etapas, desde betún a hidrocarburos cada vez más ligeros (líquidos y gaseosos). Estos productos ascienden hacia la superficie, por su menor densidad, gracias a la porosidad de las rocas sedimentarias. Cuando se dan las circunstancias geológicas que impiden dicho ascenso (trampas petrolíferas como rocas impermeables, estructuras anticlinales, márgenes de diapiros salinos, etc.) se forman entonces los yacimientos petrolíferos.
En condiciones normales es un líquido bituminoso que puede presentar gran variación en diversos parámetros como color y viscosidad (desde amarillentos y poco viscosos como la gasolina hasta líquidos negros tan viscosos que apenas fluyen), densidad (entre 0,75 g/ml y 0,95 g/ml), capacidad calorífica, etc. Estas variaciones se deben a la diversidad de concentraciones de los hidrocarburos que componen la mezcla.
Es un recurso natural no renovable y actualmente también es la principal fuente de energía en los países desarrollados. El petróleo líquido puede presentarse asociado a capas de gas natural, en yacimientos que han estado enterrados durante millones de años, cubiertos por los estratos superiores de la corteza terrestre.
En los Estados Unidos, es común medir los volúmenes de petróleo líquido en barriles (de 42 galones estadounidenses, equivalente a 158,987294928 litros), y los volúmenes de gas en pies cúbicos (equivalente a 28,316846592 litros); en otras regiones ambos volúmenes se miden en metros cúbicos.
domingo, 20 de marzo de 2011
Subproceso 5
Subproceso 5
Actividad 1: Ya hemos estudiado el petróleo y el gas natural. Ahora vamos a seguir viendo sustancias orgánicas de interés para el hombre. Para ello elige dos de los compuestos que te proponemos y especifica su constitución y para qué sirven: glúcidos, lípidos, proteínas, ácidos nucleicos, polímeros, detergentes y jabones.
Importante: Si los enlaces de la wikipedia no funcionan cuando pinchas sobre ellos, cópialos y los introduces directamente en el navegador.
Biomoléculas:
Son las moléculas constituyentes de los seres vivos. Las biomoléculas están compuestas por seis elementos que constituyen del 95 al 99% de los tejidos vivos: el carbono (C), el hidrógeno (H), el oxigeno (O), el nitrógeno (N), el azufre (S), y el fósforo (P).1 Estos seis elementos son los principales componentes de las biomoléculas debido a que:
-Permiten la formación de enlaces covalentes entre ellos, compartiendo electrones, debido a su pequeña diferencia de electronegatividad. Estos enlaces son muy estables, la fuerza de enlace es directamente proporcional a las masas de los átomos unidos.
-Permiten a los átomos de carbono la posibilidad de formar esqueletos tridimensionales –C-C-C- para formar compuestos con número variable de carbonos.
-Permiten la formación de enlaces múltiples (dobles y triples) entre C y C, C y O, C y N, así como estructuras lineales ramificadas cíclicas, heterocíclicas, etc.
-Permiten la posibilidad de que con pocos elementos se den una enorme variedad de grupos funcionales (alcoholes, aldehídos, cetonas, ácidos, aminas, etc.) con propiedades químicas y físicas diferentes.
Biomoléculas inorgánicas:
Son biomoléculas no formadas por los seres vivos, pero imprescindibles para ellos, como el agua, la biomolécula más abundante, los gases (oxígeno, ) y las sales inorgánicas: aniones como fosfato (HPO4−), bicarbonato (HCO3−) y cationes como el amonio (NH4+).
Biomoléculas orgánicas o principios inmediatos:
Son sintetizadas solamente por los seres vivos y tienen una estructura a base de carbono. Están constituidas principalmente por carbono, hidrógeno y oxígeno, y con frecuencia están también presentes nitrógeno, fósforo y azufre; otros elementos son a veces incorporados pero en mucha menor proporción.
Ácido nucleico
Los ácidos nucleicos son macromoléculas, polímeros formados por la repetición de monómeros llamados nucleótidos, unidos mediante enlaces fosfodiéster. Se forman, así, largas cadenas o polinucleótidos, lo que hace que algunas de estas moléculas lleguen a alcanzar tamaños gigantes (de millones de nucleótidos de largo).
El descubrimiento de los ácidos nucleicos se debe a Friedrich Miescher, quien en el año 1869 aisló de los núcleos de las células una sustancia ácida a la que llamó nucleína, nombre que posteriormente se cambió a ácido nucleico.
Tipos de ácidos nucleicos
Artículo principal: Estructura del ácido nucleico
Existen dos tipos de ácidos nucleicos: ADN (ácido desoxirribonucleico) y ARN (ácido ribonucleico), que se diferencian:
-por el glúcido (pentosa) que contienen: la desoxirribosa en el ADN y la ribosa en el ARN;
-por las bases nitrogenadas que contienen: adenina, guanina, citosina y timina, en el ADN; adenina, guanina, citosina y uracilo, en el ARN;
en los organismos eucariotas, la estructura del ADN es de doble cadena, mientras que la estructura del ARN es monocatenaria, aunque puede presentarse en forma extendida, como el ARNm, o en forma plegada, como el ARNt y el ARNr, y en la masa molecular: la del ADN es generalmente mayor que la del ARN.
Nucleósidos y nucleótidos
Artículos principales: Nucleósido y Nucleótido
Las unidades que forman los ácidos nucleicos son los nucleótidos. Cada nucleótido es una molécula compuesta por la unión de tres unidades: un monosacárido de cinco carbonos (una pentosa, ribosa en el ARN y desoxirribosa en el ADN), una base nitrogenada purínica (adenina, guanina) o pirimidínica (citosina, timina o uracilo) y uno o varios grupos fosfato (ácido fosfórico). Tanto la base nitrogenada como los grupos fosfato están unidos a la pentosa.
La unión formada por la pentosa y la base nitrogenada se denomina nucleósido. Cuando lleva unido una unidad de fosfato al carbono 5' de la ribosa o desoxirribosa y dicho fosfato sirve de enlace entre nucleótidos, uniéndose al carbono 3' del siguiente nucleótido; se denomina nucleótido-monofosfato (como el AMP) cuando hay un solo grupo fosfato, nucleótido-difosfato (como el ADP) si lleva dos y nucleótido-trifosfato (como el ATP) si lleva tres.
Actividad 1: Ya hemos estudiado el petróleo y el gas natural. Ahora vamos a seguir viendo sustancias orgánicas de interés para el hombre. Para ello elige dos de los compuestos que te proponemos y especifica su constitución y para qué sirven: glúcidos, lípidos, proteínas, ácidos nucleicos, polímeros, detergentes y jabones.
Importante: Si los enlaces de la wikipedia no funcionan cuando pinchas sobre ellos, cópialos y los introduces directamente en el navegador.
Biomoléculas:
Son las moléculas constituyentes de los seres vivos. Las biomoléculas están compuestas por seis elementos que constituyen del 95 al 99% de los tejidos vivos: el carbono (C), el hidrógeno (H), el oxigeno (O), el nitrógeno (N), el azufre (S), y el fósforo (P).1 Estos seis elementos son los principales componentes de las biomoléculas debido a que:
-Permiten la formación de enlaces covalentes entre ellos, compartiendo electrones, debido a su pequeña diferencia de electronegatividad. Estos enlaces son muy estables, la fuerza de enlace es directamente proporcional a las masas de los átomos unidos.
-Permiten a los átomos de carbono la posibilidad de formar esqueletos tridimensionales –C-C-C- para formar compuestos con número variable de carbonos.
-Permiten la formación de enlaces múltiples (dobles y triples) entre C y C, C y O, C y N, así como estructuras lineales ramificadas cíclicas, heterocíclicas, etc.
-Permiten la posibilidad de que con pocos elementos se den una enorme variedad de grupos funcionales (alcoholes, aldehídos, cetonas, ácidos, aminas, etc.) con propiedades químicas y físicas diferentes.
Biomoléculas inorgánicas:
Son biomoléculas no formadas por los seres vivos, pero imprescindibles para ellos, como el agua, la biomolécula más abundante, los gases (oxígeno, ) y las sales inorgánicas: aniones como fosfato (HPO4−), bicarbonato (HCO3−) y cationes como el amonio (NH4+).
Biomoléculas orgánicas o principios inmediatos:
Son sintetizadas solamente por los seres vivos y tienen una estructura a base de carbono. Están constituidas principalmente por carbono, hidrógeno y oxígeno, y con frecuencia están también presentes nitrógeno, fósforo y azufre; otros elementos son a veces incorporados pero en mucha menor proporción.
Ácido nucleico
Los ácidos nucleicos son macromoléculas, polímeros formados por la repetición de monómeros llamados nucleótidos, unidos mediante enlaces fosfodiéster. Se forman, así, largas cadenas o polinucleótidos, lo que hace que algunas de estas moléculas lleguen a alcanzar tamaños gigantes (de millones de nucleótidos de largo).
El descubrimiento de los ácidos nucleicos se debe a Friedrich Miescher, quien en el año 1869 aisló de los núcleos de las células una sustancia ácida a la que llamó nucleína, nombre que posteriormente se cambió a ácido nucleico.
Tipos de ácidos nucleicos
Artículo principal: Estructura del ácido nucleico
Existen dos tipos de ácidos nucleicos: ADN (ácido desoxirribonucleico) y ARN (ácido ribonucleico), que se diferencian:
-por el glúcido (pentosa) que contienen: la desoxirribosa en el ADN y la ribosa en el ARN;
-por las bases nitrogenadas que contienen: adenina, guanina, citosina y timina, en el ADN; adenina, guanina, citosina y uracilo, en el ARN;
en los organismos eucariotas, la estructura del ADN es de doble cadena, mientras que la estructura del ARN es monocatenaria, aunque puede presentarse en forma extendida, como el ARNm, o en forma plegada, como el ARNt y el ARNr, y en la masa molecular: la del ADN es generalmente mayor que la del ARN.
Nucleósidos y nucleótidos
Artículos principales: Nucleósido y Nucleótido
Las unidades que forman los ácidos nucleicos son los nucleótidos. Cada nucleótido es una molécula compuesta por la unión de tres unidades: un monosacárido de cinco carbonos (una pentosa, ribosa en el ARN y desoxirribosa en el ADN), una base nitrogenada purínica (adenina, guanina) o pirimidínica (citosina, timina o uracilo) y uno o varios grupos fosfato (ácido fosfórico). Tanto la base nitrogenada como los grupos fosfato están unidos a la pentosa.
La unión formada por la pentosa y la base nitrogenada se denomina nucleósido. Cuando lleva unido una unidad de fosfato al carbono 5' de la ribosa o desoxirribosa y dicho fosfato sirve de enlace entre nucleótidos, uniéndose al carbono 3' del siguiente nucleótido; se denomina nucleótido-monofosfato (como el AMP) cuando hay un solo grupo fosfato, nucleótido-difosfato (como el ADP) si lleva dos y nucleótido-trifosfato (como el ATP) si lleva tres.
martes, 22 de febrero de 2011
Suscribirse a:
Entradas (Atom)